Expliquer l’escroquerie intellectuelle : « Cristallisation à froid des argiles ».A l’école, vous avez appris que les argiles sont des roches imperméables et plastiques quand humides, modérément dures à sec, et happant la langue, donc microporeuses à sec. L’état cristallin est un état solide caractérisé par un ordre à grande distance, au moins une dizaine de distances interatomiques, et rarement au delà du millimètre, très rarement jusqu’au mètre (certains micas muscovites provenant des pegmatites de l’Oural, ainsi qu’une ou deux dendrites accidentelles dans un lingot de fer refroidi trop lentement, et surtout les monocristaux de l’industrie du silicium pour l’électronique, atteignent le mètre avec un seul cristal). Les métaux usuels sont tous cristallins, mais les cristaux que les composent sont indiscernables à l’œil nu, et même pas toujours au microscope optique de métallographie. Ces ordres à grande distance sont atteints par la répétition régulière dans trois dimensions de l’espace d’un même motif élémentaire. Ce motif élémentaire est appelé la maille cristalline. Par exemple dans le gros sel de cuisine, la maille cristalline est cubique, et vous pouvez voir à l’œil nu les cristaux résultants..
Dans les sols et les fonds marins, les argiles SONT cristallines. En revanche, les cristaux sont généralement trop petits pour être discernables au microscope optique, et relèvent bien davantage du cristallogramme X (par exemple en chambre Debye-Scherrer) que même du microscope électronique. Les tailles de grains typiques vont du centième de micromètre à un petit nombre de micromètres, pour les kaolins les plus grossiers. Ces grains sont plats, éventuellement enroulés.

Dans les fours céramiques, les argiles fondent en partie, et après cuisson les grains les plus grossiers restent reliés par un verre. Ce verre n’est autre que la phase liquide, précédemment fondue, qui s’est figée sans recristalliser.
Les aires spécifiques des argiles vont de 650 mètres carrés par gramme pour les argiles gonflantes type montmorillonite ou hectorite, à la dizaine de mètres carrés par gramme pour les plus grossières, mais encore pures. Aires à réduire en proportion de la teneur en argile d’un sol ou d’une roche réelle : les sables et schistes ont des aires spécifiques négligeables en regard de celles des argiles.
Exception : un petit groupe de matériaux argileux sont assez peu cristallisés pour être qualifiés d’amorphes, ce sont les
allophanes, présentes dans les sols volcaniques sous lessivage tropical, et considérées comme précurseurs de la kaolinite. La kaolinite nécessite un nombre d’années respectable pour atteindre la forme cristalline sous laquelle on l’exploite dans les carrières actuelles. Il semble qu’il faille au moins une alternance saison-sèche-saison-humide pour édifier chaque feuillet cristallin de sept Ångströms, et je ne serais pas étonné d’apprendre qu’il en faille plusieurs dizaines, au moins un cycle solaire de onze ans. La kaolinite présente la particularité d’être la plus alumineuse des argiles (un aluminium pour chaque silicium), et électriquement neutre, donc très pauvre en cations échangeables (en principe aucun, à peine aux bords latéraux, où les liaisons brisées peuvent se polariser légèrement en présence d’ions en solution).
Dans le monde, la principale synthèse des kaolinites a toujours été dans les sols tropicaux très lessivés.
Son schéma structurel, en élévation :
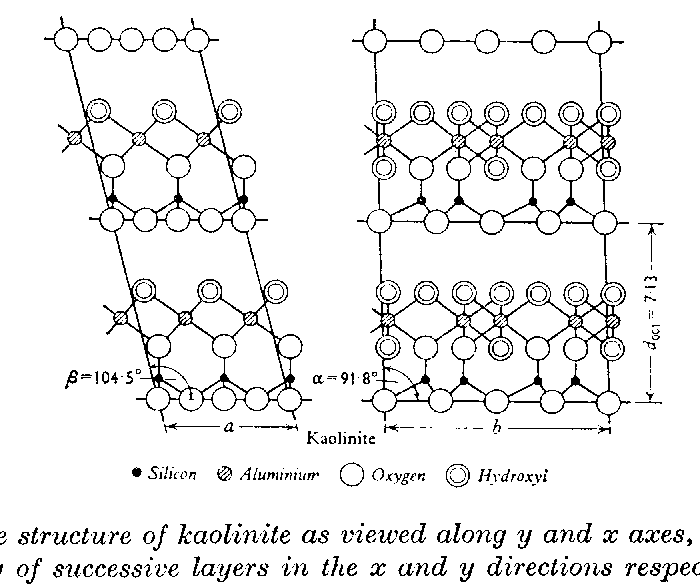
et parallèlement au plan de base :
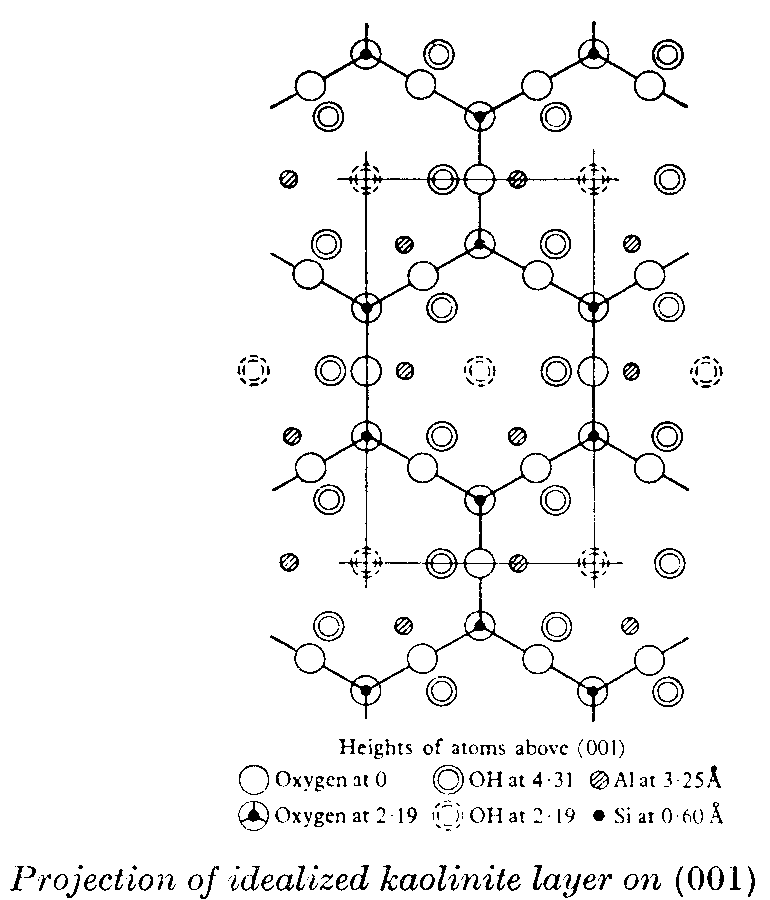
Les grands lessivages tropicaux (plus de deux mètres d’eau par an) ne laissent dans le profil de sol que les oxydes et hydroxydes de fer ferrique (goethite et hématite, plus d’autres formes non nettement cristallisées), l’hydroxyde d’aluminium (gibbsite), la kaolinite, et quelques minéraux difficiles à dissoudre, tels que des quartz résiduels, la magnétite, le zircon… Les bauxites sont toujours d’anciens sols tropicaux (ferrallitiques selon la nomenclature des pédologues) enlevés par l’érosion, et accumulés un peu plus bas.
La latérite selon la description originelle de Buchanan fut décrite aux Indes comme un sous-sol perpétuellement humide, que l’on coupe à la bêche et qui durcit définitivement à l’air, jusqu’à devenir en quelques jours plus dur qu’une brique cuite. Cette propriété originelle de la « plinthite » (nomenclature moderne) est surtout due à des formes non cristallines et hydratées d’hydroxyde d’aluminium et d’hydroxydes de fer, avec des complexes ferreux solubles et incolores, qui s’oxydent à l’air. La « latérite » d’Afrique est bien différente : ce sont surtout des cuirasses ferriques, correspondant à d’anciens bas de vallées, indurées par le fer préalablement solubilisé en complexes par les solutions fulviques provenant des litières végétales (on donne le nom collectif d’acides fulviques à la fraction la moins polymérisée, la plus soluble des acides de l’humus, réservant le nom d’acides humiques à la fraction de plus haut poids moléculaire). Ces cuirasses se sont formées dans des conditions édaphologiques bien plus couvertes et forestières qu’actuellement.
Tout autour du Massif Central, on trouve des gisements de kaolinite, plus ou moins ferrugineuse. Tous ceux que je connais proviennent de l’enlèvement de couvertures de sols tropicaux, lorsque la surrection et le découpage du Massif Central sous la poussée alpine, a livré ses épaisses couvertures de sols ferrallitiques et fersiallitiques (du Crétacé surtout, et des quelques épisodes tropicaux du Tertiaire) à l’érosion rapide.
Plus rarement, et c’était le cas de notre carrière de Saint-Jacut du Mené, la kaolinite est lacustre, formée en eaux acides et réductrices, avec abondance de pyrites, voire d’acide sulfurique. Dans de tels cas, la kaolinite coexiste avec des argiles beaucoup plus communes, ici réputées par Jean Nicolas, être de la glauconite, plus simplement dénommée illite selon d'autres auteurs, dont Philippe Toubeau. Le feuillet d'illite est symétrique comme celui des micas, d’équidistance dix Ångströms : une couche où les cations silicium sont en coordinence tétraédrique entourés d’oxygènes, une couche octaédrique occupée par des cations aluminium (assez rarement) ou magnésium (plus souvent) ou fer ferrique, et encore une couche tétraédrique de silice (argiles 2/1).
Dans les micas, ces feuillets sont boutonnés l’un à l’autre par des cations potassium. Pour cela les charges négatives capables de retenir fermement ces cations, sont bien au plus près, dans les couches tétraèdriques. Dans l’altération de surface, avec les eaux de pluie et le lessivage des cations, les micas peuvent s’altérer progressivement en argiles 2/1 : perte d’une partie des cations intersticiels, remplacés par de l’eau, substitutions partielles des cations formateurs (dans le feuillet), certains de ces cations sont remplacés par l’hydrogène de l’eau (cation hydronium), avec défauts de charges à l’intérieur de la couche octaédrique (donc champ électrique moins bien localisé), fragmentation des cristaux de plusieurs ordres de grandeur. Tous les intergrades existent entre les micas et les argiles 2/1, toutes les tailles de cristaux. Alors que les feuillets de kaolinite (argile 1/1) et de talc (phyllite lui aussi, magnésien et non alumineux, et de structure 2/1) sont électriquement neutres, les argiles vraiment plastiques et gonflantes sont des macro-anions, équilibrés par des cations échangeables, alcalins ou alcalino-terreux.
J’ai insisté sur la kaolinite, quoique minoritaire de par le monde, très minoritaire dans les régions tempérées, car elle est de loin la meilleure dans les réactions argile-chaux et argile-soude, (le plus souvent en conditions hydrothermales), qui sont le centre de ma compétence dans ces années 1974-1986. C’est la kaolinite l’argile la plus vulnérable à une attaque alcaline.
Lorsqu’on fait réagir de l’argile avec de la chaux, il se forme les hydrates usuels de la chimie des ciments, formés en partie à partir du klinker broyé, et partie par attaque de l’argile par la chaux néoformée lors de l’hydratation du ciment.
Or, ces minéraux sont pas ou peu cristallins. C’est cela la «
cristallisation à froid des argiles » ! Or le ciment est un bien moins bon fournisseur de chaux Ca(OH)2, que la chaux industrielle proprement dite, trois à dix fois moins bon, selon sa composition. Donc même si elle est encagée d’hydrates calciques qui lui donnent de la résistance mécanique, très peu d’argile est transformée, aussi reste-t-elle gonflante. C’est ce qui explique les caractéristiques de gonflement désastreuses du mélange argile-ciment, en usage avant mon arrivée, à l'INSA de Rennes, comme à l'usine de Saint-Méen. Tout cela, notre brillant professeur de béton, l’ombrageux Michel Laquerbe, l’ignorait ! Pourtant depuis environ cent ans, tout maçon savait déjà que mélanger de l’argile avec du ciment, c’est une grosse bêtise : ça gonfle et ça ne tient pas ! La seule exception concerne les chapes d’étanchéité, où l’on ajoute une
petite quantité de montmorillonite à un mortier surdosé en ciment.
 Effet rafraîchissant local...
par Jacques
Effet rafraîchissant local...
par Jacques  Le climatologue Marcel Leroux...
par Jacques
Le climatologue Marcel Leroux...
par Jacques  Les glaces d'Arctique aussi,...
par Jacques
Les glaces d'Arctique aussi,...
par Jacques  Echapper à tout contrôle de...
par Jacques
Echapper à tout contrôle de...
par Jacques  First : civil war. 2nd : civil...
par Jacques
First : civil war. 2nd : civil...
par Jacques  YBM/"Robert Winn"...
par Jacques
YBM/"Robert Winn"...
par Jacques  Les nouveaux harcèlements...
par Jacques
Les nouveaux harcèlements...
par Jacques  YBMondices d'YBM contre François...
par Jacques
YBMondices d'YBM contre François...
par Jacques  Harcèlement conjoint, YBM...
par Jacques
Harcèlement conjoint, YBM...
par Jacques  En compétition avec lui-même...
par Jacques
En compétition avec lui-même...
par Jacques  Total des membres: 51
Total des membres: 51 Latest: RobertCrara
Latest: RobertCrara Total des messages: 807
Total des messages: 807 Total des sujets: 328
Total des sujets: 328 Online Today: 8
Online Today: 8 Online Ever: 768
Online Ever: 768 Users: 0
Users: 0 Guests: 25
Guests: 25 Total: 25
Total: 25


